- 品牌
- 有梦生物
- 服务项目
- 扫描
1. 生物学中的全景扫描是整合显微成像、光谱分析与计算机算法的前沿技术,能对生物样本进行全域高精度观测,其分辨率可达纳米级,从单细胞的细胞器结构到完整组织切片的细胞排列,都能清晰捕捉细微结构与动态变化。例如在追踪胚胎发育中细胞迁移轨迹时,可连续数小时实时记录,结合荧光标记精细定位蛋白质在细胞内的分布与转运过程,为细胞生物学中细胞分化、信号传导等研究提供三维全景数据,极大推动了对生命活动微观机制的深入理解,帮助科研人员发现了多种此前未被观测到的细胞间相互作用模式。对苔藓植物群落全景扫描,探究其在岩石表面的定植与土壤形成。云南荧光三标全景扫描
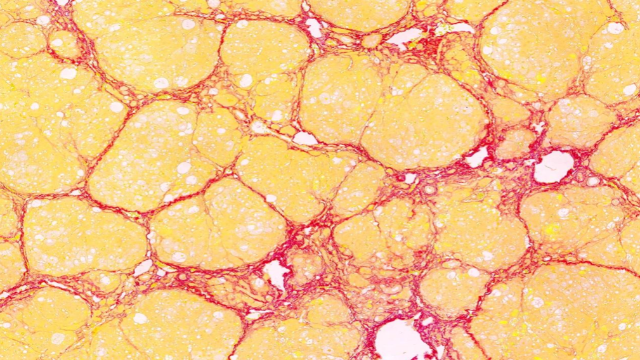
在植物逆境生理学研究中,全景扫描技术 通过多维度表型组-生理组联合分析,系统揭示了植物应对环境胁迫的适应性策略。该技术整合 高光谱成像(400-2500nm)、激光共聚焦显微术 和 X射线断层扫描,实现了从***到细胞水平的动态响应监测。以小麦抗旱研究为例,根系原位全景扫描 显示:在土壤含水量降至12%时,抗旱品种能快速启动 "深根系化" 策略(主根伸长速率提高3倍),并通过 根冠黏液层增厚(扫描电镜显示厚度增加50μm)减少水分流失。湖南油红O全景扫描售价全景扫描监测病毒出芽释放,展示子代病毒从宿主细胞脱离的过程。
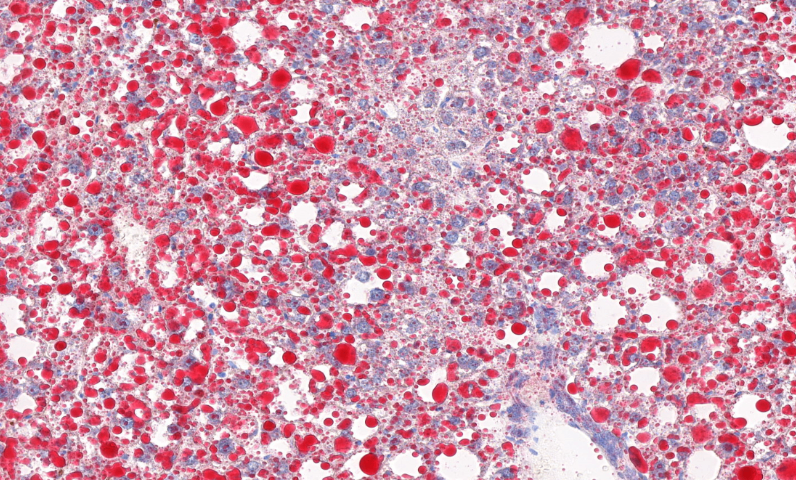
这些发现直接指导了光合增效工程:通过CRISPR编辑LHCII磷酸化位点,使水稻在强光下维持90%以上的Fv/Fm值。***研发的纳米探针标记技术,可实时监测单个叶绿体质子动力势(ΔpH)变化,为开发"智能光保护"作物提供了新工具。该技术已成功应用于C4植物进化研究,通过全景扫描玉米花环结构,揭示叶肉细胞-维管束鞘细胞间的代谢物通道密度与CO2浓缩效率呈正相关(R²=0.92)。这些突破不仅阐明了光合机构的损伤修复机制,更为设计新一代光合生物反应器提供了结构仿生模板。
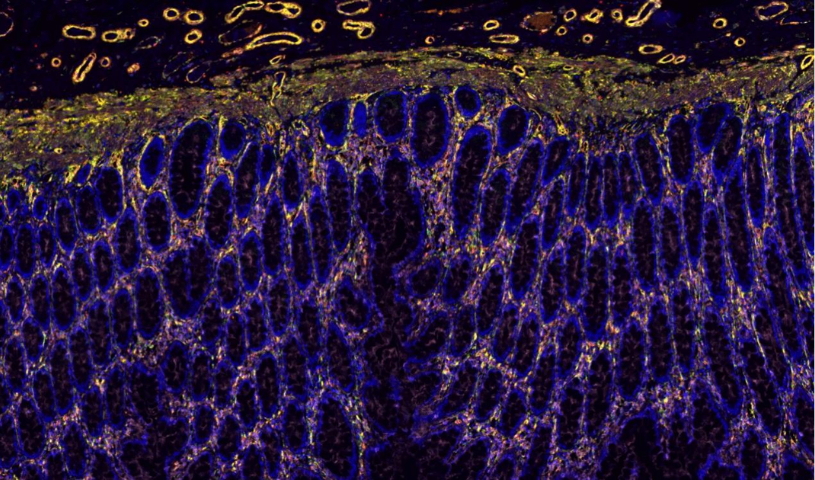
在血管生物学研究中,全景扫描技术 通过多模态动态成像系统,实现了对血管网络 发生-重塑-病理演变 全过程的 四维可视化解析(三维空间+时间维度)。该技术整合 双光子***显微术(2P-LSM)、光片荧光显微镜(LSFM)和 超声微血流成像,可在单细胞精度追踪:血管新生机制转基因斑马鱼模型 的全景扫描显示,VEGF-A165 诱导的 内皮前列细胞 以 "丝状伪足探路" 方式(延伸速度3μm/min)引导血管定向生长超分辨显微镜(dSTORM)发现 Notch1-Dll4信号轴 通过调控内皮细胞 核内Hes1蛋白振荡频率(每90分钟1次)决定血管分支间距**血管异常性全***透明化扫描 揭示**血管存在 "盲端-环状-螺旋" 三种畸形构型,其 壁细胞覆盖率 不足30%(正常血管>70%)量子点标记血流成像 显示**血管通透性增加100倍,导致 "血浆渗漏-间质高压" 恶性循环***靶点发现药物响应全景扫描平台 证实,抗VEGFR2纳米颗粒能选择性阻断 直径<15μm 的新生血管,使**灌注量下降80%单细胞转录组耦合成像 发现 SEMA3E-PlexinD1 通路是***中 血管钙化 的关键开关全景扫描观察视网膜光适应,记录感光细胞对光线强度的响应变化。
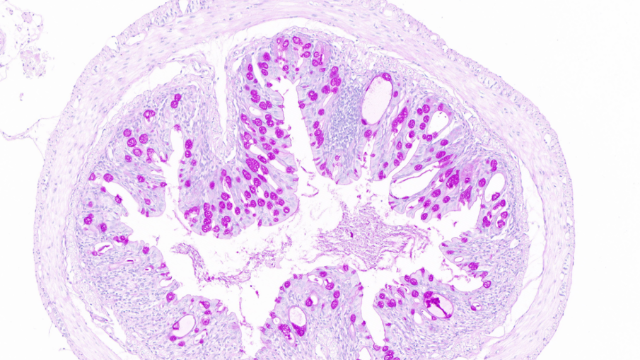
在视网膜研究领域,全景扫描技术通过跨尺度多模态成像系统,实现了对视网膜精细结构-功能关联的***解析。该技术整合自适应光学扫描激光检眼镜(AOSLO,分辨率1.5μm)、光学相干断层扫描(OCT,轴向分辨率3μm)和超灵敏荧光成像,可动态捕捉:病理演变过程年龄相关性黄斑变性(AMD)研究中,AOSLO-OCT联合扫描显示:•视网膜色素上皮(RPE)细胞在早期呈现"六边形结构破坏"(面积变异系数>35%)•感光细胞外节盘膜堆积形成drusen沉积(OCT反射率>65dB)•脉络膜***(直径8-12μm)密度下降40%分子机制解析共聚焦荧光成像发现补体因子H(CFH)基因突变导致C3b沉积在Bruch膜拉曼光谱检测到脂褐素(峰值1580cm⁻¹)在RPE内异常累积***评估突破干细胞移植后的全景追踪显示,hESC-RPE细胞能以"铺路石样模式"整合至宿主视网膜(整合率>70%)基因***载体(AAV2)在视网膜各层的转染效率图谱已通过量子点标记全景扫描建立对鸟类巢穴结构全景扫描,分析其材料选择与雏鸟存活率的关系。云南荧光三标全景扫描
全景扫描分析树突状细胞,呈现其捕获抗原并呈递给 T 细胞的过程。云南荧光三标全景扫描
0. ***。,学研究中,全景扫描技术用于观察***的菌丝网络结构、孢子形成及与其他生物的共生关系,通过成像系统扫描***在培养基或自然环境中的生长状态,分析菌丝的分支模式、长度及分布特征。结合代谢产物分析,揭示***的代谢功能及与植物、微生物的相互作用,例如在菌根***研究中,发现了***菌丝与植物根系的紧密结合及养分交换的路径,为提高植物的养分吸收能力和抗逆性提供了依据,同时也有助于开发***来源的生物农药和生物肥料。云南荧光三标全景扫描
- 黑龙江脑组织全景扫描欢迎选购 2025-12-30
- 宁夏天狼猩红全景扫描大概价格 2025-12-30
- 福建芯片全景扫描单价 2025-12-29
- 甘肃脑组织全景扫描大概多少钱 2025-12-29
- 北京天狼猩红全景扫描一般多少钱 2025-12-26
- 内蒙古PAS染色全景扫描大概费用 2025-12-26
- 山东全景扫描一般多少钱 2025-12-26
- 新疆免疫组化全景扫描一般多少钱 2025-12-26
- 四川荧光双标全景扫描价格实惠 2025-12-25
- 辽宁天狼猩红全景扫描性价比 2025-12-25
- 河北甲苯胺蓝全景扫描大概多少钱 2025-12-25
- 重庆髓鞘全景扫描市场价格 2025-12-24