- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
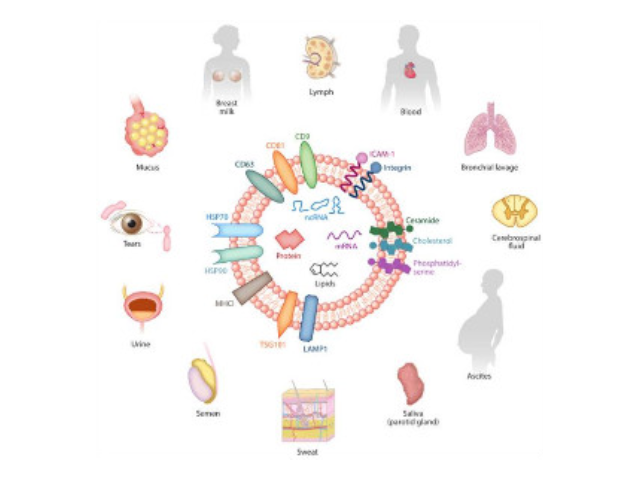
外泌体(Exosome)是细胞主动分泌的囊泡样小体,大小均一,直径30-200nm,密度1.10-1.18g/ml,来源普遍,几乎所有细胞都可分泌,在血液,尿液,唾液,脑脊液,腹水,乳汁等体液中普遍分布。外泌体较早在1986年发现于培养的绵羊红细胞上清液中。1996年,研究者发现外泌体作为抗原呈递因子参与T细胞依赖的抗一些病症反应,开启了外泌体蛋白研究的新天地。2013年诺贝尔生物/医学奖解答了细胞如何组织其内部较重要的运输系统之一——囊泡传输系统的奥秘。外泌体提取:样本的粘度与分离的外泌体纯度有显着的相关性。宁波正规外泌体提取试剂哪里买
外泌体(exosomes)是活细胞经过"内吞-融合-外排"等一系列调控过程而形成的膜性囊泡,来源于晚期核内体(也称为多囊泡体),直径约为30-150nm,密度在1.13-1.21g/ml,天然存在于血液、唾液、尿液及母乳等体液中,同时外泌体也存在于组织和细胞间隙中。人体中几乎所有类型的细胞均能产生外泌体,人体中大约有1014个外泌体,大约平均每个细胞产生1000-10000个。外泌体中含有核酸(DNA、miRNA、lncRNA、mRNA、tRF等)、蛋白和脂类,在细胞间物质和信息转导中发挥重要作用,研究表明其在干细胞、免疫调控、瘤转移、血管生成以及生物标志物等领域都发挥着不可替代的作用。开封外泌体提取试剂直销价外泌体的提取分离:超速离心法(差速离心)。

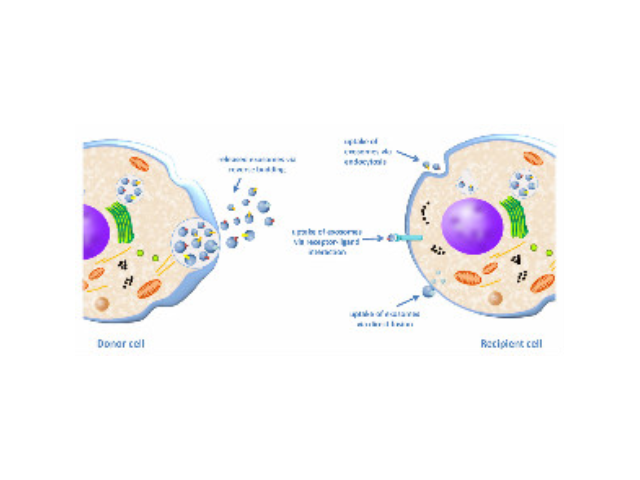
具膜囊泡,当我们使用常规方法分离这些结构时不推荐使用其他的名称来称呼它们。外泌体(exosome)适用于通过特殊手段拿到的由胞内体来源的释放到细胞外的膜泡结构。建议对细胞外囊泡进行细分时使用物理上的界定如小细胞外囊泡(sEV)和中/大细胞外囊泡(m/lEV),或者高密度囊泡(highdensity)和低密度囊泡(lowdensity)等,同时也建议使用表面蛋白来界定如CD63+CD81+细胞外囊泡等。当使用exosomes等称呼时应当进行严谨的实验证明使用的“exosomes样品”是由胞内体途径产生的。小和同学:都是细胞外囊泡,外泌体和微囊泡有啥区别?小光老师:外泌体和微囊泡的区别在于其生成的方式不同。从晚期内体来源产生的细胞外囊泡称为外泌体,从细胞膜直接出芽产生的细胞外囊泡称为微囊泡。
1983年,外泌体初次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究。外泌体目前被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。如何高效地提取外泌体是实现这项新兴液体活检技术临床常规化应用的关键。也可以作为治病手段,未来有可能作为药物的天然载体用于临床治病。

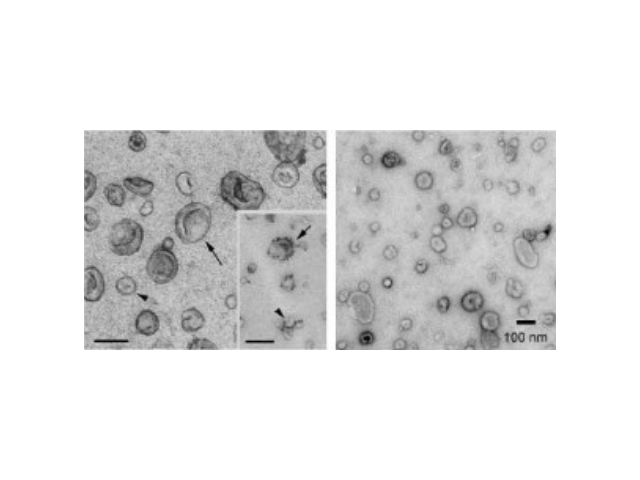
外泌体的生物学功能研究中需要分离完整的外泌体颗粒,而传统超速离心方法步骤繁琐、硬件要求高、操作难度大。李记生物自主开发的外泌体快速提取试剂盒,组分经过优化处理,适用于细胞培养上清液、血清、血浆、尿液及其他体液(脑脊液、腹水、羊水、乳汁以及唾液等)中的外泌体提取,并搭配纯化过滤装置,可快速高效地获得高纯度外泌体颗粒。注意事项:1.对于待测样品粘度过大时,可将样本用4℃预冷的1×PBS缓冲液进行等体积稀释处理。2.当血清、血浆、唾液等样品收获的外泌体浓度较高,收获的外泌体颗粒无法通过EPF柱纯化时,可用4℃预冷的1×PBS进行稀释后再通过EPF柱离心。3.针对外泌体标志蛋白(CD63,CD9,CD81等)进行Westernblot检测,可以鉴定所提的外泌体。通过超速离心(120000g/分钟)20小时以上才能获得足够的外泌体量在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。合肥正规外泌体提取试剂价格
早先应用于从血清等样本中收集细菌,现在也被用来沉淀外泌体,其原理可能与竞争性结合游离水分子有关。宁波正规外泌体提取试剂哪里买
外泌体作为近几年来的研究热点,受到了科研工作者的青睐及追捧。由于外泌体内携带有大量的miRNA,少量lncRNA,Mrna以及DNA蛋白质成为液体活检的潜力无限的研究对相。所以,获得纯度高、内容物完整的外泌体非常之重要,那么,外泌体的提取方法也显得尤为重要。一、差速离心法差速离心法可以说是传统普遍的外泌体提取方法。原理是:首先低速离心以除去细胞和细胞凋亡碎片;随后,高速离心以去除大囊泡;高速离心以沉淀外泌体。苏州君欣生物科技有限公司宁波正规外泌体提取试剂哪里买
外泌体的提取、分离方法:开发高效、快速、稳定,并且保持外泌体结构和生物功能完整性的方法,是目前外泌体应用于临床的基础和前提。从细胞上清和体液中提取分离外泌体的方法很多,但是外泌体的纯度和产量却和分离方法息息相关。通常分离步骤少、产率高,但是纯度会受到影响。鉴于每种分离方法都有其优缺点,实验可以根据样本来源、下游实验目的等,选择合适的外泌体分离方法。2015年,国际囊泡组织(InternationSocietyforExtracelluarVesicles,ISEV)指出,简单依靠一种分离方法得到的外泌体的纯度和产量都难满足实验的需求。因此,推荐联合使用各种方法,从而得到高纯度和高产量的外泌体。...
- 宁波正规外泌体提取试剂厂家供应 2025-12-24
- 天津正规外泌体提取试剂产品介绍 2025-12-24
- 天津正规外泌体提取试剂供应商 2025-12-24
- 合肥外泌体提取试剂厂家现货 2025-12-24
- 正规外泌体提取试剂厂家直销 2025-12-24
- 南京正规外泌体提取试剂单价 2025-12-24
- 金华外泌体提取试剂厂家 2025-12-23
- 石家庄外泌体提取试剂哪家好 2025-12-23
- 开封外泌体提取试剂哪家便宜 2025-12-23
- 天津正规外泌体提取试剂哪家好 2025-12-23
- 合肥正规外泌体提取试剂厂家现货 2025-12-22
- 济南外泌体提取试剂产品介绍 2025-12-22
- 杭州外泌体提取试剂产品介绍 2025-12-22
- 重庆正规外泌体提取试剂厂家批发价 2025-12-21
- 重庆正规外泌体提取试剂直销价 2025-12-21
- 深圳正规外泌体提取试剂厂家 2025-12-21


- 珠海正规细胞外基质胶厂家供应 12-24
- 南京武汉RNA提取试剂 12-24
- 正规无血清细胞冻存液产品介绍 12-24
- 温州无血清细胞冻存液服务电话 12-24
- 上海唐山RNA提取试剂 12-24
- 杭州正规细胞外基质胶推荐厂家 12-24
- 珠海正规无血清细胞冻存液直销厂家 12-24
- 天津正规外泌体提取试剂产品介绍 12-24
- 南京深圳原代细胞分离试剂盒 12-24
- 厦门正规无血清细胞冻存液单价 12-24