- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
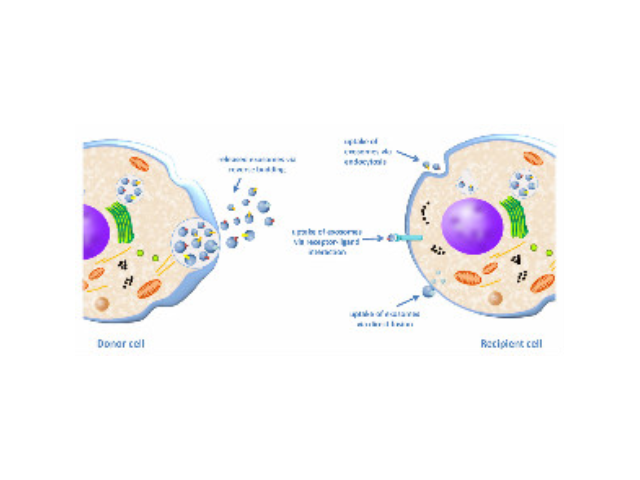
人体几乎所有类型的细胞都能分泌外泌体,外泌体普遍存在并分布于各种体液中,携带多种蛋白质、mRNA、miRNA和脂质类物质等,作为重要的传递信号分子,形成了一种全新的细胞-细胞间信息传递系统,可参与细胞通讯、细胞迁移、血管新生和一些病症细胞生长等过程。外泌体与微泡:我们知道,细胞间相互作用可以通过释放蛋白质、核酸、脂质等分子到胞外与受体结合从而介导胞内细胞传导。除此之外,细胞还可以释放膜囊泡,外泌体与微泡就是其中两种,二者相似但形成方式不同:外泌体是细胞内内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中的膜囊泡,而微泡则是细胞出芽与细胞膜融合后直接脱落形成的囊泡,且外泌体大小均一,直径在40~100nm,其大小取决于其起源部位以及细胞中的脂质双层结构;而微泡大小不一,直径在50~1000nm之间。同时可获得高纯度和高回收率的外泌体——如新西兰IZON开发的系列的外泌体排阻剂。昆明正规外泌体提取试剂

外泌体(exosome)是所有细胞释放出的细菌大小的颗粒。它们天然地存在于血液中。根据来自美国德州大学MD安德森一些疾病中心的一项新的研究,对外泌体进行基因操纵可能提供一种新的胰腺病治病方法。论文通信作者为德州大学MD安德森一些疾病中心一些疾病生物学系研究员RaghuKalluri博士。在这项新的研究中,经过基因修饰的外泌体(被称作iExosome)能够运送特异性地靶向KRAS突变基因的小RNA分子,从而导致胰腺病模式小鼠病情缓解,增加它们的总存活率。这些研究人员采用了一种被称作RNA干扰(RNAi)的靶向方法:利用这些天然的纳米颗粒(即外泌体)运送小干扰RNA(siRNA)或短发夹RNA(shRNA)分子来靶向胰腺病细胞中的KRAS突变基因,从而影响多种胰腺病模型的一些病症负荷和存活。他们证实外泌体能够作为一种高效的RNAi载体发挥作用,这是因为这些纳米大小的囊泡(即外泌体)轻松地在体内迁移和进入靶细胞(包括病细胞)中。开封正规外泌体提取试剂生产厂家早先应用于从血清等样本中收集细菌,现在也被用来沉淀外泌体,其原理可能与竞争性结合游离水分子有关。

2015年,随着精细医学概念的提出,越来越多的人开始关注如何能做到疾病的精确诊断和治病。外泌体作为一个新型的研究热点,由于它在体内存在的普遍性和获取的便捷性,已经成为了疾病诊断治病的潜在有效方式,在精细医学发展上有着光明的前景。多泡内体的腔内囊泡,要么分选进溶酶体将物质降解,要么作为外泌体分泌到胞外环境中。将膜分选到不同的腔内囊泡群中的机制尚不清楚。该研究发现物质被分选到内体膜上的不同子域中,并且外泌体相关结构域向内体腔的转移不取决于ESCRT(运输所需的内体分选复合体)的功能,但是需要鞘脂神经酰胺。纯化的外体富含神经酰胺,并且在神经鞘磷脂酶被压制后外泌体释放减少。这些结果确定了内体内膜运输和外泌体形成的途径。
外泌体RNA促进一些病症生长和转移:研究发现exosomes参与了一个很特别的一些病症发展机制:在大部分一些病症样本中,是不存在细菌传染的;但携带抗细菌信号(ISG,干扰素刺激基因)的一些病症侵袭性会更强,比如三阴性乳腺病侵袭性的病例。一些病症细胞是如何让正常细胞作出抗细菌反应的呢?研究表明,一些病症细胞刺激成纤维细胞,让它释放含有末端暴露的RN7SL1(这种RNA很类似细菌RNA)的exosomes,受体细胞吸收这种exosomes后,会误以为受到了细菌传染,正常的炎症应答就会因此被扰乱,exosomes中末端暴露的RN7SL1则作为DAMP信号启动乳腺病的RIG-I,较终达到促进一些病症生长以及耐药的目的。这项研究结果更重要的意义在于,表明一些病症患者血清分泌的exosomes中的RN7SL1有望作为炎症和不良预后的biomarker,甚至是治病靶点。同时,也启示exosomes研究者,除了小RNA,exosomes中其他类型的RNA一样具有潜在的研究意义。利用化合物沉淀将法外泌体沉淀出来。
外泌体:已经有研究报道了各种Hh的胞外转运机制,但实际用于体内Hh分泌和转运的途径尚不清楚。该研究显示Hh在果蝇翅膀成虫盘的分泌依赖于运输所需的内体分选复合物(ESCRT)。在体内,产生Hh的细胞中ESCRT活性的降低导致外部细胞表面保留Hh。此外,产生Hh的细胞中的ESCRT活性对于长距离信号传导是必需的。证据表明Hh和ESCRT蛋白质的库在体内一起分泌到细胞外空间中,并且随后可以在受体细胞的表面一起被检测到。这些发现揭示了ESCRT蛋白质在控制形态发生活性中的新功能,揭示了一种新的机制,通过细胞外囊泡在组织中转运分泌的Hh,这是长距离靶向诱导所必需的。磁珠法具有特异性高、操作简便、不影响外泌体形态完整等优点。太原正规外泌体提取试剂直销厂家
现已证实可以分泌外泌体的细胞有:肥大细胞、淋巴细胞、树突状细胞、一些病症细胞、间充质干细胞等。昆明正规外泌体提取试剂
研究初次发现疟原虫传染小鼠血浆外泌体(exosomes)能够压制一些病症血管生成,并初步阐明其分子机制。研究加深了对疟原虫传染宿主所分泌的外泌体与一些病症血管生成之间的相互作用的认识,为开发疟原虫传染来源的外泌体作为一种新型抗一些病症制剂奠定了基础。研究人员选用肺病小鼠模型作为研究对象,从传染疟原虫的小鼠血浆中获得外泌体,并将这些外泌体注射到小鼠的一些病症内部,并与没有疟原虫传染的小鼠血浆外泌体进行对照。研究发现,疟原虫传染小鼠的血浆外泌体明显压制一些病症血管的生成。进一步的研究发现,疟原虫传染的小鼠血浆外泌体通过至少四种特殊的微小RNA(miR16-5p/17-5p/322-5p/497-5p)压制血管内皮细胞VEGF受体(VEGFR2)的表达从而阻断血管生成的信号通路。这些发现加深了人们对疟原虫抗病机理的理解,并为疟原虫疗法治病一些疾病的临床研究提供进一步的理论依据。昆明正规外泌体提取试剂
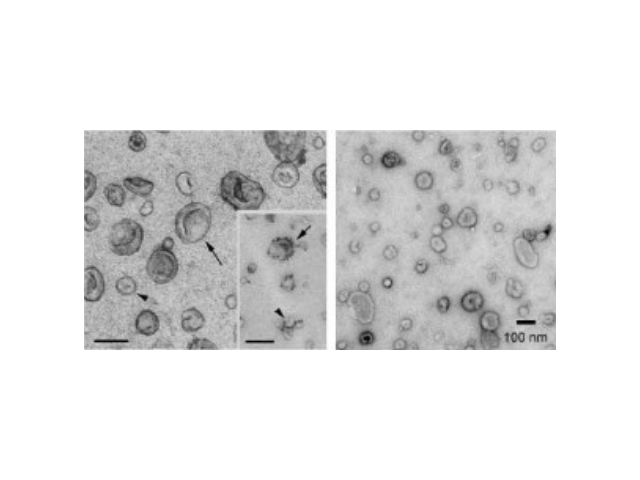
外泌体的形成与鉴定:首先,细胞膜内陷形成一个杯状结构,包括细胞表面蛋白和与细胞外环境相关的可溶性蛋白,导致早期胞内体(early-sortingendosome,ESE)的从头形成,或者是杯状结构直接和已经存在的ESEs融合;trans-高尔基体和内质网也能协助形成ESEs。ESE成熟后形成晚期胞内体(late-sortingendosomes,LSEs),较终形成MVBs(也称为多囊内小体)。MVBs是通过endosome限制膜向内凹(即质膜双凹)形成的,这一过程导致MVBs含有多个ILVs。MVB可以与溶酶体或自噬体融合,较终降解或与质膜融合释放作为外泌体的ILVs。外泌体表面蛋白包括四聚...
- 芜湖正规外泌体提取试剂 2025-12-27
- 宁波外泌体提取试剂服务电话 2025-12-27
- 杭州外泌体提取试剂厂家现货 2025-12-26
- 无锡外泌体提取试剂生产厂家 2025-12-26
- 太原正规外泌体提取试剂进货价 2025-12-26
- 深圳正规外泌体提取试剂推荐厂家 2025-12-25
- 成都正规外泌体提取试剂厂家供应 2025-12-25
- 天津外泌体提取试剂厂家直销 2025-12-25
- 开封外泌体提取试剂单价 2025-12-25
- 南京外泌体提取试剂哪家好 2025-12-24
- 合肥外泌体提取试剂厂家现货 2025-12-24
- 正规外泌体提取试剂厂家直销 2025-12-24
- 南京正规外泌体提取试剂单价 2025-12-24
- 金华外泌体提取试剂厂家 2025-12-23
- 石家庄外泌体提取试剂哪家好 2025-12-23
- 开封外泌体提取试剂哪家便宜 2025-12-23


- 正规细胞高效转染试剂哪家便宜 12-31
- 正规细胞高效转染试剂哪家好 12-30
- 浙江正规糖原染色试剂盒销售厂家 12-30
- 温州正规无血清细胞冻存液进货价 12-30
- 珠海细胞高效转染试剂直销价 12-30
- 唐山细胞高效转染试剂产品介绍 12-30
- 唐山细胞高效转染试剂进货价 12-30
- 深圳正规细胞高效转染试剂单价 12-30
- 福建正规糖原染色试剂盒 12-30
- 厦门正规原代细胞分离试剂盒单价 12-30