- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
外泌体的提取分离:1、超速离心法(差速离心)。超离法是常用的外泌体纯化手段,采用低速离心、高速离心交替进行(如图所示),可分离到大小相近的囊泡颗粒。超离法因操作简单,获得的囊泡数量较多而广受欢迎,但过程比较费时,且回收率不稳定(可能与转子类型有关),纯度也受到质疑;此外,重复离心操作还有可能对囊泡造成损害,从而降低其质量。2、密度梯度离心。在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。通过密度梯度离心,样品中的外泌体将在1.13-1.19g/ml的密度范围富集。此法获得的外泌体纯度较高,但步骤繁琐,耗时。外泌体提取:高速离心以消除更大的囊泡。郑州外泌体提取试剂平均价格
外泌体的提取、分离方法:微流控技术。微流控是利用微纳米级尺寸的管道来处理和操控流体所涉及的一门技术,其在外泌体分离方面的应用受到越来越多学者的关注。Jie等[16]课题组开发了一种三维纳米结构微流控芯片,微柱阵列通过化学沉积将交叉多壁碳纳米管功能化,然后其就可以识别特定的分子(CD63)并利用独特拓扑纳米材料高效的捕获外泌体。Wunsch等[17]利用硅工艺生产纳米级确定性侧向位移(Nano-DLD)芯片,得到了均匀的间隙尺寸,该芯片可以灵敏地将20~110nm的颗粒分离。该研究证明了外泌体基于大小的位移,从而揭示了利用芯片分选和量化纳米级生物胶体的潜力。开封外泌体提取试剂报价外泌体提取:聚乙二醇(PEG)为常用的多聚物,可与疏水性蛋白和脂质分子结合共沉淀。
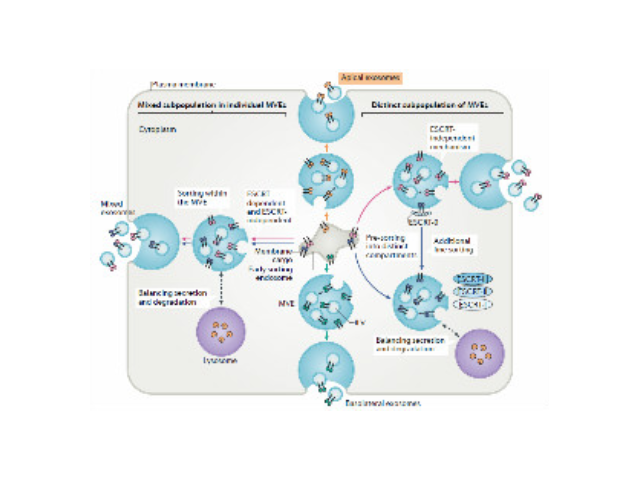
2015年,随着精细医学概念的提出,越来越多的人开始关注如何能做到疾病的精确诊断和治病。外泌体作为一个新型的研究热点,由于它在体内存在的普遍性和获取的便捷性,已经成为了疾病诊断治病的潜在有效方式,在精细医学发展上有着光明的前景。多泡内体的腔内囊泡,要么分选进溶酶体将物质降解,要么作为外泌体分泌到胞外环境中。将膜分选到不同的腔内囊泡群中的机制尚不清楚。该研究发现物质被分选到内体膜上的不同子域中,并且外泌体相关结构域向内体腔的转移不取决于ESCRT(运输所需的内体分选复合体)的功能,但是需要鞘脂神经酰胺。纯化的外体富含神经酰胺,并且在神经鞘磷脂酶被压制后外泌体释放减少。这些结果确定了内体内膜运输和外泌体形成的途径。
外泌体在肺病治病中的作用:有研究发现,使用外泌体运载紫杉醇(PTX)可显着提高病细胞对PTX的吸收,将PTX加载至外泌体中显着增加了药物细胞毒性,Exo-PTX能显着压制肺病的发展。Aqil等在进行裸鼠实验时发现,加载至外泌体中的雷公藤红素(Exo-CEL)比普通的CEL有更强的抗一些病症功效,且在小鼠中未发现明显全身性或系统性毒性,由此可以证明,外泌体制剂可以有效增强CEL功效并降低与剂量有关的毒性。到目前为止,外泌体在肺病治病方面的研究主要集中于免疫压制,有效的外泌体药物递送平台的搭建以及外泌体相关的潜在治病靶点的探索。已有的研究表明外泌体在肺病治病领域有着广阔的前景,期待外泌体在肺病治病领域早日得到突破,造福更多的患者。正规外泌体提取试剂供应商通过超速离心(120000g/分钟)20小时以上才能获得足够的外泌体量。通过离心筛选初步去除体液中的细胞成分和细胞碎片,制成体液样本备用。

外泌体的提取、分离方法:免疫亲和层析法。免疫亲和层析法是利用生物体内存在的抗原、抗体之间高度特异性的亲和力进行分离的方法,主要用于生物大分子的分离、纯化。将其应用于外泌体的分离主要是借助外泌体表面的特异性抗体,如TSG101或四跨膜蛋白。此方法的原理是利用抗原抗体的特异性结合,只有囊泡表面有特异性的抗体才可以被识别,这使得提取的外泌体纯度高,但是产量低。Zarovni等分别用超速离心、密度梯度离心和免疫层析法,从血浆和细胞上清中提取外泌体蛋白,结果表明,免疫亲和层析法得到的外泌体表面存在多种标记蛋白(Alix、CD9、CD63),同时,ELISA和PCR结果也证明了该方法的可行性。外泌体的提取分离:密度梯度离心。徐州正规外泌体提取试剂推荐厂家
由于这些核酸被囊膜包裹而被保护,稳定性高,不易降解。郑州外泌体提取试剂平均价格
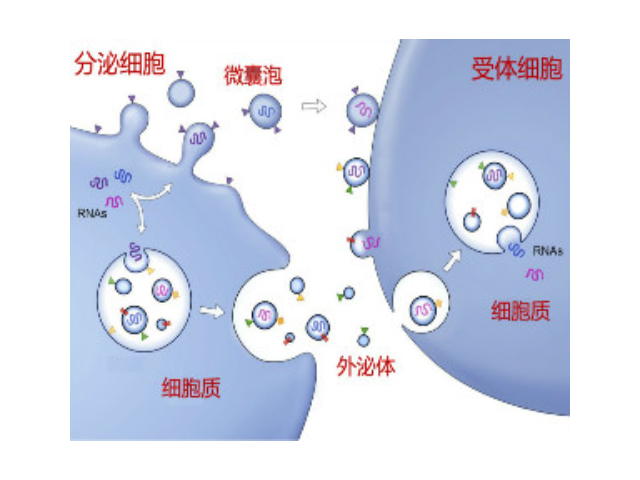
外泌体因诺贝尔医学奖而被众人知晓,也因其作为生命信息传递者,在体液中普遍存在及易获得性等特点被誉为液体活检"新贵",成为疾病的精确诊断和治病研究的热点,尤其是在一些病症研究领域[。外泌体作为细胞间通信载体的作用现在已被普遍接受。外泌体包含胞质环境中富含的DNA,RNA,蛋白质和其它分析物,研究表明,外泌体中的运转RNA和蛋白质与一些病症的生长密切相关,有望作为诊断标志物。研究发现Vps4A是一个外泌体的重要调控因子,与肝病的发生有着密切的关系,Vps4A基因的表达下调肝病的发生及转移相关。通过microRNA高通量测序发现Vps4A基因能导致外泌体分泌肝病相关的重要microRNA,与肝病的发生密切相关。郑州外泌体提取试剂平均价格
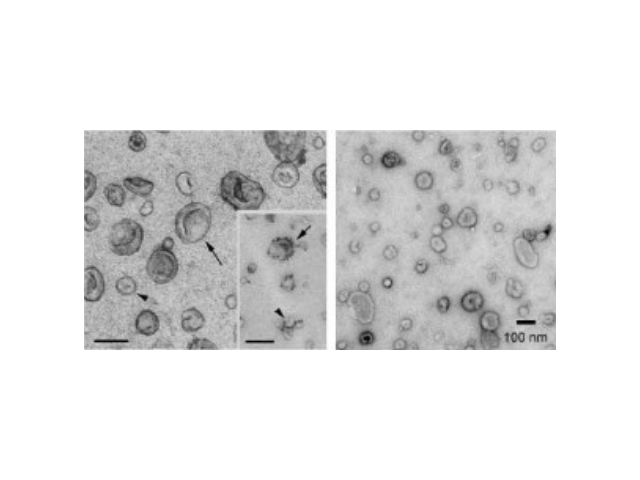
外泌体(exosomes)是活细胞经过"内吞-融合-外排"等一系列调控过程而形成的膜性囊泡,来源于晚期核内体(也称为多囊泡体),直径约为30-150nm,密度在1.13-1.21g/ml,天然存在于血液、唾液、尿液及母乳等体液中,同时外泌体也存在于组织和细胞间隙中。人体中几乎所有类型的细胞均能产生外泌体,人体中大约有1014个外泌体,大约平均每个细胞产生1000-10000个。外泌体中含有核酸(DNA、miRNA、lncRNA、mRNA、tRF等)、蛋白和脂类,在细胞间物质和信息转导中发挥重要作用,研究表明其在干细胞、免疫调控、瘤转移、血管生成以及生物标志物等领域都发挥着不可替代的作用直接把外...
- 深圳正规外泌体提取试剂直销价 2026-02-25
- 太原外泌体提取试剂平均价格 2026-02-25
- 成都正规外泌体提取试剂供应商 2026-02-25
- 长沙外泌体提取试剂哪家好 2026-02-25
- 重庆外泌体提取试剂供应商 2026-02-24
- 武汉正规外泌体提取试剂厂家推荐 2026-02-24
- 济南外泌体提取试剂直销价 2026-02-24
- 金华外泌体提取试剂厂家推荐 2026-02-24
- 南京正规外泌体提取试剂产品介绍 2026-02-24
- 南昌外泌体提取试剂哪里买 2026-02-24
- 深圳外泌体提取试剂供应商 2026-02-14
- 徐州正规外泌体提取试剂厂家批发价 2026-02-13
- 贵阳正规外泌体提取试剂厂家现货 2026-02-13
- 北京外泌体提取试剂直销厂家 2026-02-13
- 成都外泌体提取试剂报价 2026-02-13
- 徐州正规外泌体提取试剂直销价 2026-02-13


- 厦门鼠尾胶原厂家直销 02-25
- 重庆正规外泌体提取试剂价格 02-25
- 深圳正规外泌体提取试剂直销价 02-25
- 芜湖RNA提取试剂哪里买 02-25
- 金华唐山细胞外基质胶 02-25
- 石家庄正规鼠尾胶原 02-25
- 徐州细胞外基质胶价格 02-25
- 徐州细胞外基质胶进货价 02-25
- 深圳细胞外基质胶推荐厂家 02-25
- 开封RNA提取试剂直销厂家 02-25