湖州申科生物依托高分辨质谱技术推出宿主细胞蛋白定制化检测服务组合,覆盖生物制品残留蛋白分析需求。该平台提供四类服务:HCP蛋白检测定制化服务;通过ELISA、双向电泳(2D)及LC-MS/MS技术,支持常规生物制品检测、高危及工艺相关蛋白数据库构建以及特殊生物制品分析;抗体覆盖率服务采用自主研发的IMBS技术结合质谱,准确评估ELISA试剂盒对工程细胞HCP的捕获能力,并完成校准品表征;靶向HCP检测专注于高风险残留蛋白的方法开发;同时提供蛋白种属鉴定服务,利用LC-MS技术溯源样品中的物种特异性肽段。该服务体系通过多技术联用与深度定制化策略,满足从基础筛查到工艺关键杂质监控的全维度需求。
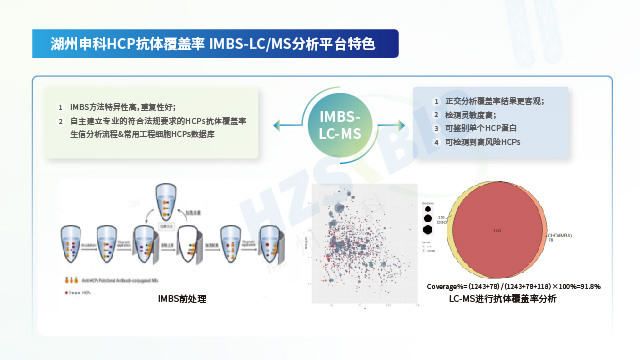
湖州申科搭建高分辨蛋白质谱技术平台,结合IMBS技术,推出了IMBS-MS抗体覆盖率评估方法。成都生物制品宿主细胞蛋白(HCP)残留检测免疫策略
按照美国药典1132章节的要求,HCPs校准品需满足代表性要求,即能覆盖实际工艺产品生产中的HCPs。从HCP免疫检测方法使用目的和预期风险管理要求考虑,满足工艺开发和验证,同时为了应对下游工艺中潜在的异常工艺失效,或工艺变更需求,建议采用上游发酵工艺末端,如澄清处理后工艺点的样本作为HCPs的来源。在实际制备中,可采用空细胞或空载细胞在模拟实际工艺的预定条件进行采集,通过二维电泳或高分辨率质谱等蛋白质组学方法进行模拟工艺和实际工艺下HCPs的代表性表征分析。越靠近下游HCPs蛋白种类越少,也越接近DS中HCPs,但是其可能无法满足工艺开发和验证需求,也无法保证工艺的潜在风险,往往不推荐使用,或只作为上游工艺HCPs免疫检测法的辅助使用。
Sf9宿主细胞蛋白(HCP)残留检测方法开发抗体覆盖率评估分析需要考虑不同方法间存在的差异,以及如何持续改进和评估方法实验过程的质量控制。
湖州申科生物参考USP通则<1132.1>阐述的内容,依托公司深耕生物制品质量控制领域十余年经验,针对LC-MS检测HCPs方法进行了评价与优化。同时通过对LC-MS检测HCPs整体流程建立完整的质控,建立起一套抗干扰能力强、稳定性好、准确度高、结果真实可靠的LC-MS检测HCPs标准方法。检测技术平台分成样品制备、质谱检测、数据生信分析及质谱结果方法验证四部分,已使用LC-MS平台进行了293T、不同工艺E.coli、CHO、Vero、MDCK、Sf9等不同工程细胞HCPs抗体覆盖率的检测分析。
HEK 293细胞来源于人胚肾细胞,广泛应用于细胞与基因治疗领域,如病毒载体的生产等。尽管生物制品会经过一系列纯化工艺以去除相关杂质,但残留的微量宿主细胞蛋白(HCP)仍会引发机体的免疫应答,影响产品的质量和安全。因此,需要对生产工艺中残留的HEK 293 HCP进行定量检测,使其符合放行标准。湖州申科生物HEK 293 HCP残留检测试剂盒(一步酶联免疫吸附法)适用于HEK 293和HEK 293T来源的生物制品(重组蛋白类、细胞和基因治疗类等)中宿主细胞蛋白的定量检测。试剂盒检测步骤少,快速,专一性强,性能稳定可靠。
宿主细胞蛋白(HCP)残留检测对保障生物制品安全性和有效性至关重要。
针对宿主细胞蛋白残留检测,工艺特异型检测试剂盒(upstream-process)专为特定生产工艺设计,其关键在于使用产物的实际宿主细胞进行开发与验证,模拟真实生产流程获取广谱HCP抗原,并要求抗血清具备高度覆盖率以适应工艺变动,确保对特定生产流程残留的高度准确监控。平台型检测试剂盒(platform)则由生产商针对其特定表达宿主细胞和相近工艺自行开发,其优势在于可使用相同的参考标准品和试剂统一监测在该宿主上生产的不同产品,适用于上游工艺足够相似的产品线。通用型检测试剂盒(commercial)则作为市售广谱方案,适用于相似宿主细胞的常规检测,但因其制备过程可能无法完全模拟目标产物的实际生产,必须严格评估多克隆抗体对特定产品HCP的覆盖率,以保证检测可靠性。三类试剂盒覆盖从深度定制到通用筛查的不同需求。
HCP检测的经典方法是ELISA法,但该方法在检测过程中存在漏检风险,需要对试剂盒抗体进行抗体覆盖率评估。广东宿主细胞蛋白(HCP)残留检测桥接验证
工艺特异型、平台型、通用型HCP检测试剂盒各有特点,满足不同需求。成都生物制品宿主细胞蛋白(HCP)残留检测免疫策略
美国药典<1132>章节 和欧洲药典<2.6.34>章节建议对于即将进入商业化生产的(临床III期及以后)或生产工艺稳定的生物制品采用定制化ELISA试剂盒进行宿主细胞蛋白(HCP)残留检测,原因可能是:①确保检测方法可以充分覆盖实际工艺产生的HCPs,避免漏检关键杂质;②支持更准确的免疫原性和安全性评估;③提供真实的工艺表征数据,而非推测数据;④满足商业化生产质量控制的方法一致性。此外,对目前市场上常见的HCP ELISA商业化试剂盒进行了测试,并与HCP ELISA定制化试剂盒进行对比,实验结果发现不同商业化试剂盒检测同一样品的检测值差异大,且准确性均低于定制化试剂盒,表明定制化试剂盒更能满足产品质量控制所需。
成都生物制品宿主细胞蛋白(HCP)残留检测免疫策略