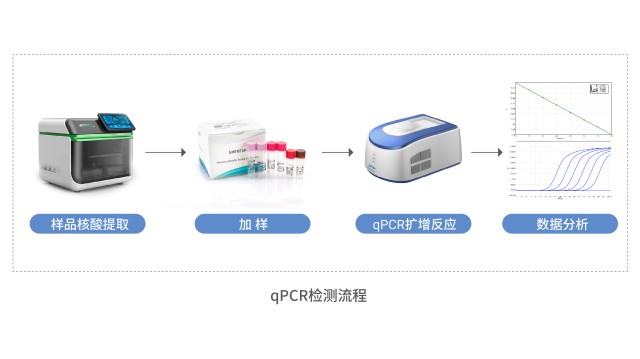
若宿主细胞残留 DNA 检测扩增效率未达标,建议分阶排查。第一步查数据:调取标曲扩增图,核对是否呈标准 S 型、整体荧光值是否过低、复孔信号是否重叠、通道选择是否恰当、是否存在离群孔及程序参数是否准确。第二步查耗材设备:验证 EP 管是否无菌低吸附,移液器与 PCR 仪是否在校验期内,仪器与耗材规格是否匹配。第三步查人员试剂:对比是否只有个别操作者结果异常,确认试剂储存温度及冻融次数是否合规,并定位异常是否自某时点集中爆发。完成三轮筛查后,细审操作:梯度稀释是否充分涡旋且时长足够,吸液前是否预润吸头,移液速度是否一致,MIX 是否适度颠倒或短时涡旋,上机前是否再次离心混匀,分析时基线区间与阈值设定是否得当,ROX 修正步骤是否执行到位。实时定量PCR(qPCR)凭借高灵敏度和特异性,成为宿主细胞残留DNA检测的主流方法。四川生物制品宿主细胞残留DNA检测方案
围绕宿主细胞残留DNA检测,湖州申科生物搭建了完整的开发流程。第一步借助生物信息学分析进行引物探针设计,筛选适宜的靶标序列并构建高效引物探针。第二步确认PCR-荧光探针法检测体系,标准曲线需设置至少5个浓度点,扩增效率控制在83.3%-110%、R²≥0.980,同时保障方法的专属性与合理定量限。第三步推进方法验证,确保符合《中国药典》四部9101、ICHQ2(R2)等指导原则及相关申报规范。第四步实施样品检测,参照《中国药典》三部3407、USP<509>标准,设置充足的中间质控样品,通过多环节管控保障检测的科学性、规范性与可靠性,为宿主细胞残留DNA检测提供有效技术支撑。
四川qPCR法宿主细胞残留DNA检测常见问题宿主细胞残留DNA检测体系的稳定性依赖于参考品标定和试剂批间差异控制。
SHENTEK® CHO 残留 DNA 检测试剂盒,可对各类生物制品及药品的中间品、半成品与成品中残留的 CHO 宿主细胞 DNA 进行定量检测。该试剂盒基于荧光探针原理实现对样品中 CHO 残留 DNA 的定量,不仅检测高效快速、专一性突出、性能稳定可靠,检测限还能达到 fg 级别。试剂盒配套提供 CHO DNA 定量参考品,且该参考品已通过严格溯源至国家标准品,能有效保障检测结果的准确性与可追溯性。该试剂盒与 SHENTEK® 宿主细胞残留 DNA 样本前处理试剂盒搭配使用,能够准确定量样品中残留的微量 CHO 细胞 DNA。
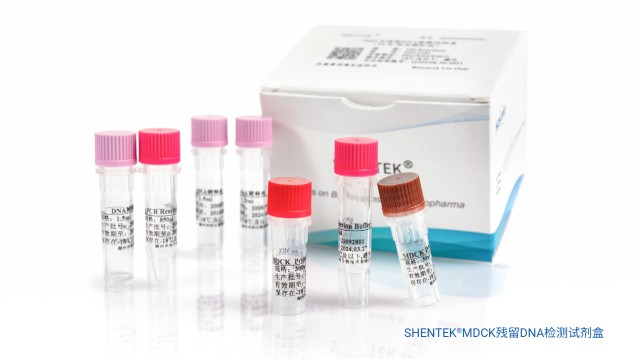
SHENTEK® MDCK 残留 DNA 检测试剂盒,可对各类生物制品中间品、半成品及成品中的 MDCK 宿主细胞 DNA 开展定量检测。该试剂盒凭借荧光探针原理实现对样品中 MDCK 残留 DNA 的定量检测,不仅检测速度快、专一性突出、性能稳定可靠,检测限还可达到 fg 级别,且试剂盒内还配套提供 MDCK DNA 定量参考品。该试剂盒与 SHENTEK® 宿主细胞残留 DNA 样本前处理试剂盒搭配使用,整个分析系统通过优化前处理与检测步骤的适配效果,提升 MDCK 细胞微量 DNA 残留的回收率及定量准确度。
湖州申科生物系列宿主细胞残留DNA检测试剂盒配套参考品,已溯源至国家标准品。
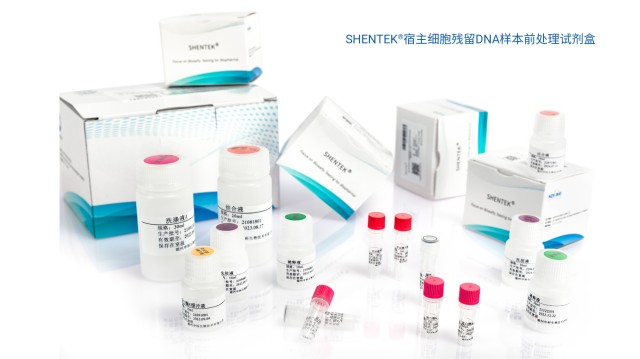
湖州申科生物疫苗制剂宿主细胞残留DNA样本前处理试剂盒,采用磁珠法进行核酸提取纯化。结合疫苗制剂的产品特性,该试剂盒优化了试剂配方,适用于疫苗成品(如Vero细胞生产的狂犬病疫苗)中Vero残留DNA的样品前处理,能稳定高效获取样品中的痕量DNA,可与各款SHENTEK®宿主细胞DNAqPCR检测试剂盒搭配使用。此外,该试剂盒可借助rHCDpurify®前处理系统实现样品自动处理。若样品含铝佐剂或右旋糖苷,具体处理方式可咨询湖州申科生物技术股份有限公司。
单克隆抗体与重组蛋白药物领域,需检测 CHO 细胞等残留 DNA,把控药物安全与有效性。昆虫细胞(杆状病毒)宿主细胞残留DNA检测
宿主细胞残留DNA检测磁珠法自动化提取实现高通量样品处理,提升效率。四川生物制品宿主细胞残留DNA检测方案
启动宿主细胞残留 DNA(HCD)检测方法验证前,需围绕文件要求与样品处理两大维度做好准备。文件要求上,应通过研究方案、研究计划、报告或标准操作程序(SOP),提前明确规范生物分析方法的具体内容,为后续验证奠定合规基础。样品处理方面,若检测中样品出现抑制现象,可考虑采用稀释方式解决,但稀释后的检测值需处于可信区间内;对于复杂样品,若稀释无法消除抑制影响,则需通过样品前处理手段提取 DNA 后再开展检测,以此保障检测结果的准确可靠,确保 HCD 方法验证高效、顺利推进。
四川生物制品宿主细胞残留DNA检测方案