检测限验证是支原体 NAT 方法(核酸扩增法)合规性的关键要求,法规明确界定需为每种目标支原体确定阳性检测临界值。验证流程需满足严格的实验设计:每种支原体至少进行三次单独的 10 倍梯度稀释,每次稀释后需制备平行管检测,再确保各稀释浓度获得 24 个检测结果。阳性临界值的判定标准为,该浓度下至少 95% 的试验运行能得到阳性结果,即 24 个样品中需至少出现 23 个有效阳性结果。这一严谨设计旨在确保 NAT 检测方法在实际应用中,能够稳定检出低浓度支原体污染,避免因检测灵敏度不足导致的安全风险,为生物制品质量控制提供可靠保障。
全血基质中100 CFU/mL支原体,湖州申科支原体检测试剂盒通过优化提取流程实现稳定扩增与检出。山东干细胞产品支原体检测国产替代
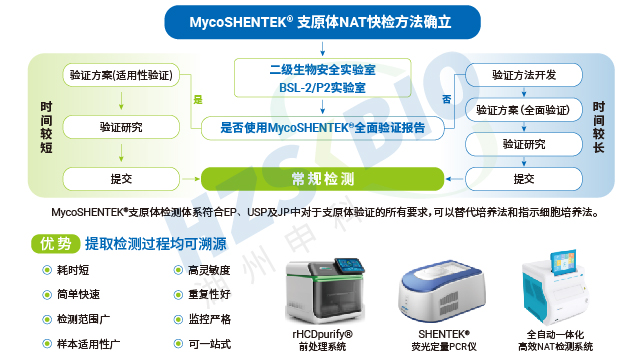
AdvSHENTEK外源因子全自动核酸检测分析系统凭借优越性能,为支原体检测提供坚实技术支撑。硬件方面,系统温度运行精度≤0.5℃,温度波动控制在 ±0.5℃以内,荧光强度 CV≤3%,确保检测结果的重复性与准确性;4 通道单独运行且支持同步检测,通道可叠加延展,兼顾检测效率与灵活性。软件方面,系统具备三级权限管理、日志审计追踪功能,完全符合 21CFR Part11 法规要求,支持 LIMS 系统连接、USB 数据导出及打印机直接打印,满足企业合规追溯需求。此外,系统运输与储存便捷,仪器可常规运输,检测试剂盒在 2-8℃环境下即可稳定保存,无需特殊冷链条件,进一步提升了产品的实用性与适配性。
湖北细胞疗法产品支原体检测国产替代支原体检测 NAT 法验证需包含空白限测试,确保无基质背景干扰。
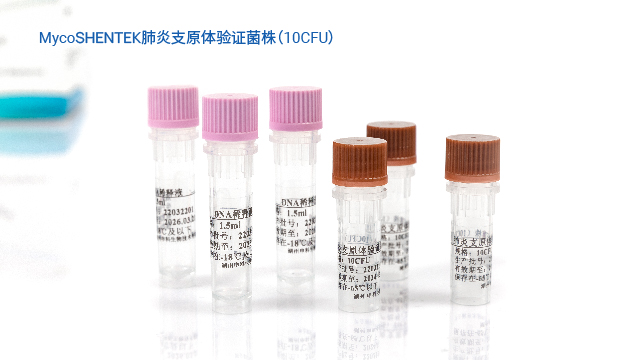
湖州申科推出的 MycoSHENTEK® 支原体验证菌株,符合全球药典要求,目前已提供口腔支原体、肺炎支原体、猪鼻支原体三种菌株,后续将逐步扩充其他验证用菌株。该系列菌株溯源至全球保藏机构并获得正式授权,经培养法测定 CFU(菌落形成单位)与 dPCR 法测定 GC(基因组拷贝数),实现准确定量标定,浓度涵盖 10CFU 和 100CFU 两种规格,每盒含 3 管,完全满足支原体检测方法验证需求。菌株经灭活处理,无风险,使用时只需加入相应体积样品基质即可开展验证,操作便捷,同时通过双重定量检测确保质量可控,为 NAT 方法验证提供可靠的标准物质支撑。
支原体检测中,污染引发的假阳性是生物制品企业的痛点。实验室环境控制不当、人员操作不规范、仪器耗材混用等因素,都可能导致核酸气溶胶污染或上样污染,进而影响检测结果。一旦出现假阳性,企业需花费大量时间排查验证,严重时会导致批次报废、影响其他产品正常生产。常规 NAT 检测法虽比传统培养法快速,但仍存在明显短板:需配备前处理设备、PCR 仪器等多重耗材,核酸提取、PCR 上机、高浓度产物处理等多个环节均有污染风险;实验准备需 40-60 分钟,操作耗时超 4 小时,每天只能完成 1-2 轮单一类型样本检测,且对场地和人员技能要求极高,需单独划分试剂准备区、样品制备区等多个区域,人力与场地成本高昂。
EP 新规明确支原体验证菌株 GC/CFU 比值<10,需在指数阶段收获以保障活性与分散性。
湖州申科外源因子全自动核酸检测分析系统打造了 “样本进、结果出” 的高效检测流程,彻底简化支原体检测操作。检测只需一步式加样,最大支持 1mL 样本直接上样,无需复杂前处理,加样后系统自动完成核酸提取与检测,全程 3 小时内即可获取结果,其中样本准备时间不足 5 分钟,检测流程只需 2.5 小时。相比传统方法水浴消化、磁珠分离、洗脱等繁琐步骤,该系统操作极大简化,且配备 UI 触屏控制系统,内置标准化程序,支持扫码启动检测,无需专业 qPCR 操作培训,普通人员经简单指导即可上手。系统采用 4 通道单独运行设计,可同步开展不同样本检测,仪器还支持叠加延展通道,进一步提升检测产能,适配生物药多批次检测需求。
高浓度质粒样品在进行支原体检测时,需通过浓缩离心预处理,提升支原体检出率。福建复杂基质支原体检测指示细胞培养法
支原体检测 NAT 法引物设计需平衡覆盖范围与特异性,避免交叉反应。山东干细胞产品支原体检测国产替代
抑制物质检测是支原体培养法的关键前置环节,旨在排除供试品中抑制成分对检测的干扰。湖州申科按 USP 标准执行:对供试品进行一次抑制物质检测,若生产方法发生变化可能影响支原体检测结果,需重复该检测。检测通过两组平行实验对比实现:一组培养基加入供试品,另一组不加供试品,同步开展营养特性测试,判断供试品是否含抑制物质。若检出抑制物质,需通过适当方法中和或抵消其作用,例如使用不含抑制剂的底物,或将供试品稀释在更大体积的培养基中,确保支原体能在检测体系中正常生长,避免因抑制成分导致检测结果失真。
山东干细胞产品支原体检测国产替代