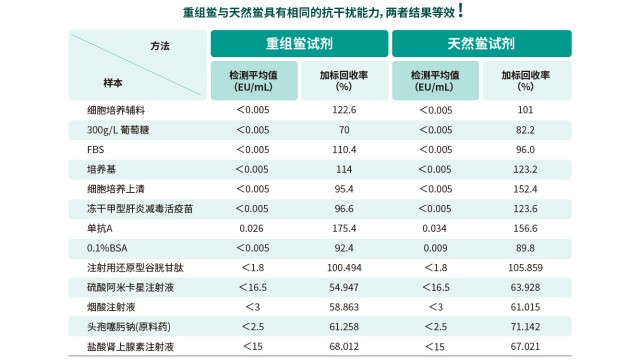
内毒素检测方法验证需覆盖多项参数,确保方法可靠:线性范围需包含样品预期浓度(如 0.01-10 EU/mL),相关系数 R²≥0.98;准确度通过加标回收率评估,应在 50%-200% 范围内;精密度包括批内和批间精密度,CV 值均应≤15%;检测限(LOD)需低于产品限值的 1/2(如限值 0.5 EU/mL,LOD 应≤0.25 EU/mL);专属性需证明无干扰物质影响(如 β- 葡聚糖、蛋白质不引发假阳性)。验证通过后,方法需经实验室负责人批准方可使用,且定期需进行一次回顾性验证,确认方法持续有效。
内毒素检测方法多样,影响因素及实验干扰较多,包括实验操作步骤、样品处理等方面。浙江抗体药物内毒素检测动态显色法鲎试剂
低内毒素回收(LER)的主要形成机制之一是螯合剂与非离子表面活性剂的协同作用,直接影响内毒素检测结果。第一步,样品中的螯合剂(如柠檬酸盐)会去除二价阳离子(Mg²⁺、Ca²⁺),削弱 LPS 聚集体的盐桥结构,降低其刚性;第二步,表面活性剂(如吐温 20)嵌入 LPS 分子,形成混合聚集体(胶体、层状结构),改变 LPS 的超分子形态。LPS 从 “可检测态” 转为 “不可检测态”,导致鲎试剂中的 C 因子无法与内毒素结合,内毒素检测出现假阴性。这种变化是时间依赖的,与稀释度无关,给常规内毒素检测带来独特挑战。
广东医疗器械内毒素检测动态显色法鲎试剂细菌内毒素检查有凝胶法和光度测定法,结果有争议时,除规定外以凝胶限度试验为准。
低内毒素回收(LER)与传统鲎试剂干扰(抑制 / 增强)在多维度存在差异,准确区分对优化内毒素检测至关重要。表现上,LER 是内毒素回收率<50%,传统干扰是反应抑制或增强;成因上,LER 由螯合剂 + 表面活性剂协同或蛋白质电荷结合引发,传统干扰因 pH、β- 葡聚糖等导致;排除方式上,LER 时间依赖且无法稀释解决,传统干扰浓度依赖且可通过稀释缓解;确认方法上,LER 需通过保存时间研究(HTS),传统干扰按药典干扰实验评估。明确这些区别能帮助企业排查内毒素检测异常,避免误将 LER 当作普通干扰处理。
2024年7月26日,《美国药典》微生物委员会正式宣布,将第<86>章“使用重组试剂的细菌内毒素测试”纳入(USP-NF),该标准定于2025年5月正式生效。这一重要举措不仅标志着细菌内毒素检测领域从此正式迈入非动物源试剂的崭新发展阶段,更契合了全球生命科学领域遵循的3R原则(即通过非动物源技术替代动物实验、减少实验动物使用量、优化实验流程以降低动物痛苦)。此前传统细菌内毒素检测多依赖从鲎血中提取的试剂,而鲎作为海洋濒危“活化石”,其资源保护与检测需求间的矛盾长期存在;如今重组级联试剂(rCR)凭借技术创新成功替代传统鲎血,在有效守护蓝血鲎的生态未来、缓解资源依赖困境的同时,也为药品生产中的内毒素质量控制和用药安全保障,提供了更先进、更稳定且具备长期可持续性的解决方案。
重组级联试剂(rCR)推动内毒素检测向可持续发展转型,兼顾生态保护与药品安全质控。
鲎试验法(LAL 法)是细菌内毒素检测的经典方法,依据反应监测方式可分为三类:凝胶法、浊度法和显色法。凝胶法通过观察是否形成凝胶判断内毒素是否超标,其优势是操作简便、成本较低,适用于定性或半定量检测,如医疗器械初筛;浊度法通过监测反应体系浊度变化速率定量内毒素,灵敏度高(可达 0.005 EU/mL),适用于生物制品原液等高精度需求场景;显色法基于显色底物的吸光度变化定量,抗干扰能力较强,适配复杂基质样品(如含蛋白质的注射液)。三种方法均需严格控制反应温度(37℃±1℃)和时间,确保结果可靠性。
重组级联试剂(rCR)无动物源,不含 G 因子,可避免 β- 葡聚糖致内毒素检测假阳性。浙江抗体药物内毒素检测动态显色法鲎试剂
脂质体样本用重组鲎试剂检测,可稀释或用 DMSO 裂解,释放包裹的内毒素以便检出。浙江抗体药物内毒素检测动态显色法鲎试剂
重组级联试剂(rCR)通过完整模拟天然鲎试剂的酶促级联反应路径,实现高效且特异的内毒素检测。其反应机制为:内毒素首先活化重组 C 因子,活化的 C 因子进一步活化重组 B 因子,随后活化重组凝固酶原转化为凝固酶,再催化显色底物产生黄色信号(405nm 波长可检测)。这一级联放大过程有效提升了检测灵敏度,即使微量内毒素也能产生可识别信号。与单因子的重组 C 因子法(rFC)相比,rCR 的多因子级联反应抗干扰能力更强,尤其对复杂基质样品(如高蛋白单抗、疫苗)表现更优。同时,rCR 剔除了天然鲎试剂中的 G 因子,避免了与 β-D 葡聚糖的非特异性反应,从根本上减少假阳性结果,保障检测数据的可靠性。
浙江抗体药物内毒素检测动态显色法鲎试剂